Pesquisa ajuda a entender a dor associada a infecções virais
Estudo publicado na revista Brain, Behavior, and Immunity pode ajudar a entender melhor a dor associada a infecções provocadas por vírus e, com isso, abrir caminhos para novos tratamentos analgésicos. O artigo mostra que o reconhecimento de certos ácidos nucleicos, como o DNA viral, por um sensor imunológico chamado STING –presente nos neurônios responsáveis pela detecção da dor (os nociceptores)– pode ativar um canal conhecido por mediar a sensação de dor.
Analisando camundongos infectados com HSV-1, um vírus “parente” do Varicella zoster (causador da catapora e do herpes-zóster), os cientistas constataram que a ausência de STING nos nociceptores resultou em uma redução significativa da dor, sem afetar a inflamação ou a carga viral.
Esse resultado sugere que a sinalização do sensor imunológico está diretamente ligada à dor, independentemente da inflamação. Os cientistas acreditam que a descoberta pode ser relevante também para outras infecções virais, incluindo o SARS-CoV-2 (causador da Covid), cuja interação do vírus com STING e sua associação com a dor foram recentemente relatadas.
Frequentemente, a dor é um dos indicadores iniciais de uma infecção viral, mas os processos pelos quais ela é induzida ainda têm lacunas para a ciência. As células imunológicas normalmente reconhecem os ácidos nucleicos virais, que ativam os receptores e a sinalização viral, levando à resposta imune. Esses receptores e sinais virais estão presentes nos nociceptores.
“Demonstramos neste artigo que o reconhecimento de partes do vírus, provavelmente o DNA, por STING participa do processo de indução de dor. Pelo menos parte dele seria diretamente ligada a uma ativação do neurônio, e não à inflamação. Isso abre várias perspectivas. A grande questão agora é o quanto isso pode tornar o indivíduo mais suscetível”, diz à Agência Fapesp o professor Thiago Mattar Cunha, da Faculdade de Medicina de Ribeirão Preto da USP (Universidade de São Paulo), autor correspondente do artigo juntamente com Temugin Berta, do Centro Médico da Universidade de Cincinnati (Estados Unidos).
Cunha explica que o grupo está pesquisando o papel desse mecanismo na proteção do indivíduo à infecção para buscar tratamentos que evitem a dor, mas não afetem a defesa imunológica.
“A dor sempre foi associada ao processo inflamatório, mas na última década começou a surgir na literatura científica um novo conceito: o de que microrganismos – bactérias e fungos – poderiam ativá-la por meio de seus ‘produtos’. Mais recentemente surgiram evidências de que vírus poderiam ativar neurônios nociceptivos ao expressar alguns receptores, como o STING. Por isso, começamos a explorar essa via”, lembra o professor, que integra o Centro de Pesquisa em Doenças Inflamatórias (CRID), um Centro de Pesquisa, Inovação e Difusão (CEPID) da Fapesp.
Em 2017, Cunha foi coautor de um artigo publicado no Journal of Neuroscience ostrando que mecanismos imunológicos desencadeados pelo vírus Varicella zoster, quando ele é reativado, alteram o funcionamento dos neurônios sensitivos e resultam em neuralgia herpética (leia mais em: agencia.fapesp.br/25627).
À época, uma das contribuições desse trabalho desenvolvido no CRID foi a validação de um modelo animal para o estudo dos mecanismos moleculares envolvidos na dor herpética, o mesmo utilizado na pesquisa agora publicada. Como o Varicella zoster não infecta camundongos, o grupo utilizou um microrganismo “parente”, o HSV-1, vírus do herpes simples que, em humanos, pode causar feridas labiais e genitais.
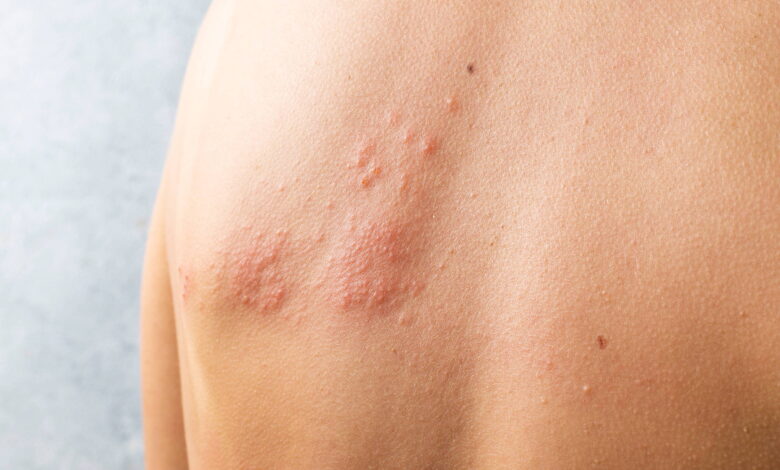
Já o Varicella zoster provoca em crianças a catapora (também conhecida como varicela), uma doença infecciosa, altamente contagiosa, mas geralmente benigna, cuja principal característica clínica são lesões na pele que se apresentam como máculas, pápulas, vesículas e crostas, acompanhadas de coceira. Uma vez adquirido o vírus, a pessoa fica imune à catapora, mas ele permanece no organismo, podendo ser reativado na vida adulta e causar o herpes-zóster (cobreiro), que passou a ser reconhecido como infecção frequente em portadores de HIV.
No Brasil não existem dados consistentes da incidência de varicela, já que somente os casos graves de internação e as mortes são de notificação compulsória. No entanto, o Ministério da Saúde estima que sejam cerca de 3 milhões de casos ao ano. Análise Epidemiológica realizada em maio de 2024 apontou que houve 25.605 internações pelo Varicella zoster entre 2013 e 2023 no país, sendo 26% na faixa etária dos 70 aos 79 anos.
Processo
A ativação de STING tradicionalmente “recruta” uma proteína (a TBK1), que induz a produção de moléculas essenciais na resposta imune, os interferons. No entanto, o estudo mostrou que a inibição de TBK1 reduziu a dor, enquanto o bloqueio de interferons não teve efeito, sugerindo que STING pode desencadear dor por caminhos independentes.
Por fim, foi demonstrado que a ativação de STING ativa um canal iônico – TRPV1 – levando à despolarização dos nociceptores. Esse mecanismo pós-transcricional também é novo em relação ao que se conhece sobre a sinalização de STING.
Informação
Folha de São Paulo